理解发病率,患病率和年度百分比变化概念,避免被误导
译者评论:
重要信息:”过度诊断说”所依据的是猜测,而非真实数据。
筛查从无到建立过程中,乳腺癌数据的变化:
1)筛查建立之前,乳腺癌发病率逐年上升。这是事实数据,而非猜测。
2)筛查建立之初,乳腺癌发病率加快上升,因为初次筛查检测的是乳腺癌”历史存量”,而不仅仅是新发癌症。
3)筛查普及之后,乳腺癌“历史存量”逐渐“去库存”,发病率会下降接近筛查建立前的基准线,但会略高于基准线,因为初次进行筛查的女性人群是“带存量”人群。举例,40岁开始乳腺癌筛查,那么第一次参加筛查的40岁女性人群中,所检测到的癌症是她们之前的“历史存量”,而不仅仅是新发癌症。
4)“过度诊断说”,依据的假设是,乳腺癌发病率逐年不变(这个不是事实)。基于这个错误假设,后来筛查中发现大量癌症,被冠以为无临床意义的“假癌症”,因此指责筛查造成“过度诊断”。
5)按照实际基准线趋势,乳腺X射线摄影筛查最终降低了癌症发病率,特别是浸润性癌症发病率。
![]()
“同行评议”审稿方式有时效果不佳,导致大量错误信息被发表,进入医学文献。混淆筛查重要性的主要错误之一是:未能了解乳腺癌发病率随时间的变化这一事实。
发病率(Incidence)
“发病率”是指在特定时间段内(通常每年)诊断出的新癌症的发生率。在美国,通常将其表示为每年每1,000名女性患癌症的人数,有时也表示为每年每100,000名女性患癌症的人数。由于新癌症的发病率随着女性年龄的增长而增加,因此年发病率从40岁时的约1/1000稳定增长到50岁时的2/1000增长到60岁时的3/1000和70岁时的4/1000。
患病率(Prevalence)
这是给定时间人群中癌症的总数,但用于筛查时,则是指首次对一组女性进行筛查时发现的癌症数。这个数字总是大于上面介绍的“发病率”,因为它包含了在开始筛查之前,该人群中累积的癌症:1)它包括在筛查开始的那一年其癌症临床症状变得明显(肿块,增厚,分泌物等)的女性;2)它也包括具有乳腺癌迹象或症状临床明显(肿块,增厚,分泌物等)的女性,但是在筛查开展前被忽视了;3)最后它包括癌症临床症状隐匿的女性,其癌症仅通过筛查检测到。
年度百分比变化(APC)
APC是指乳腺癌发病率从一年到下一年随时间变化的百分比。一旦开始筛查,数据就会受到癌症检出率的影响。关于筛查的一个主要顾虑来自这个声称:筛查可检测到大量的、但无临床意义的癌症。如果这样的癌症存在(其实不存在),那么对它们的检测就导致“过度诊断”和对“假癌症“的治疗。这被错误地称为”筛查的危害“。乳腺癌的发病率,在筛查开展之前,一直在稳定增长。了解这一事实,对于理解那些误导性声明至关重要。
在有关筛查的辩论中,被忽略的主要信息之一是:在筛查开展之前,乳腺癌的发病率是多少?这是“筛查前的基线”。大多数人会假设:每年的发病率相同,因此它必须是如图1所示的直线。
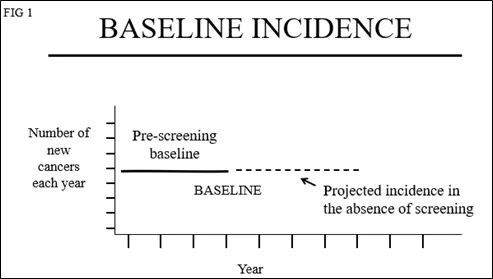
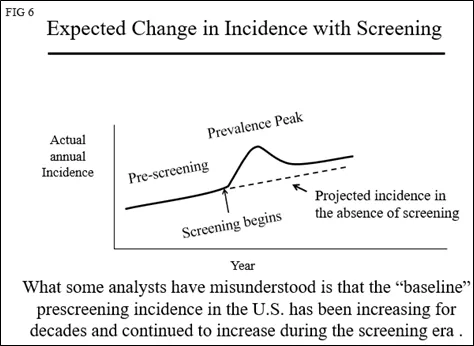
如果在开始筛查之前乳腺癌的发生率没有变化,则基线风险中的“年度百分比变化(APC)”应该为 0(曲线持平)。筛查开始时,患病高峰的开始将如图2所示。
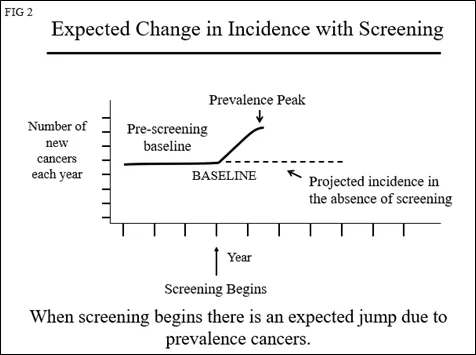
如果继续筛查同一女性人群以发现新的癌症(“发病筛查”),那么每年发现的病例数将返回基线(图3)。
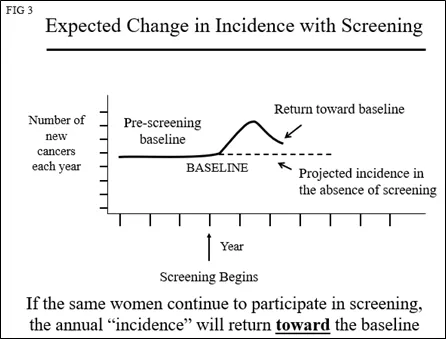
由于癌症以相同的速度上升到可被检测到的水平,因此“发病率”将与基线平行,但是会更高一些,因为有新的女性开始参与筛查(包含其“患病率”癌症的影响)。由于筛查可提前1-4年发现乳腺癌,其发病率曲线将发生变化,年轻女性的发病率将表现为高于她们几岁的女性的发病率(图4)。
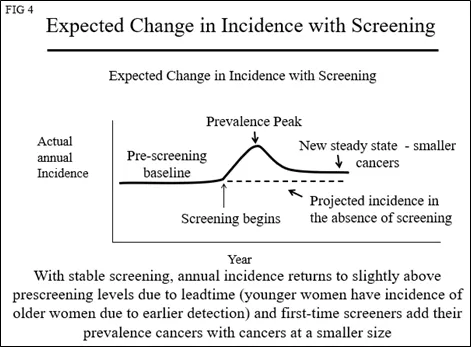
然而,在美国(图5)和世界各地,乳腺癌的发病率在筛查之前一直稳定增长。这可能是由于营养的改善(较年轻的月经初潮年龄)和推迟了第一次足月妊娠(年轻的足月妊娠可降低患乳腺癌的风险),以及未知的环境风险。这意味着“基线”发病率不是一条水平线,而是每年都在增加,如图6所示。
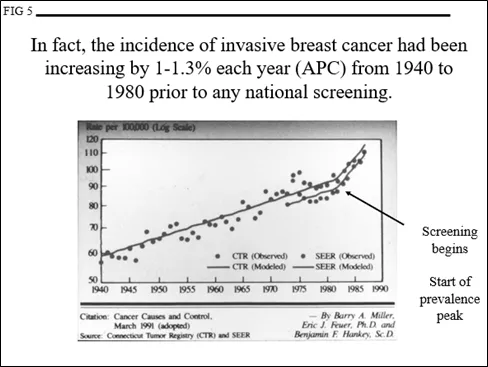
如果基线不断上升(意味着每年实际有更多的女性患乳腺癌),则曲线必须倾斜以反映1-1.3%的APC(图7)。

所有声称筛查导致“大量过度诊断”的,其分析的数据,都假设基线近似一条水平线(Bleyer A, Welch HG. Effect of three decadesof screening mammography on breast-cancer incidence. N Engl J Med. 2012 Nov22;367(21):1998-2005),或就是一条水平线(Welch HG, Gorski DH, Albertsen PC. Trends in Metastatic Breast andProstate Cancer. N Engl J Med. 2016 Feb 11;374(6):596)。“我们从这样的假设开始:具有临床意义的乳腺癌,其发生概率是稳定的(APC=0)”,如图8所示。


但误导者们忽略数据而妄做结论:由于实际癌症数量高于他们假设的,没有筛查情况下的癌症数量,因此他们认为一定是无临床意义的“假癌症”被筛查发现(图9)。他们所忽略的实际数据是:在开始筛查之前的几十年中,每年乳腺癌的发病率一直在稳定增长,每年的百分比变化(APC)为每年1-1.3%(Anderson WF, Jatoi I, Devesa SS.Assessing the impact of screening mammography: Breast cancer incidence and mortality rates in Connecticut (1943-2002). Breast Cancer Res Treat. 2006Oct;99(3):333-40)。
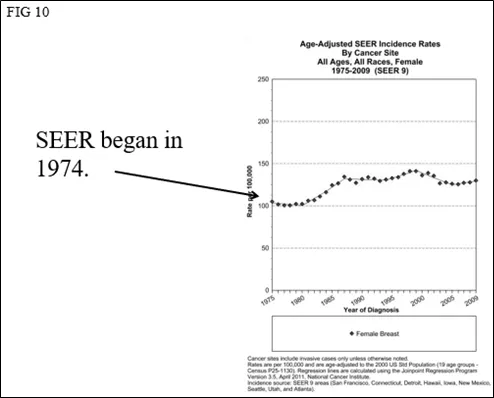
如果我们查看来自美国SEER程序的实际数据(图10),我们会看到误导者们的错误。
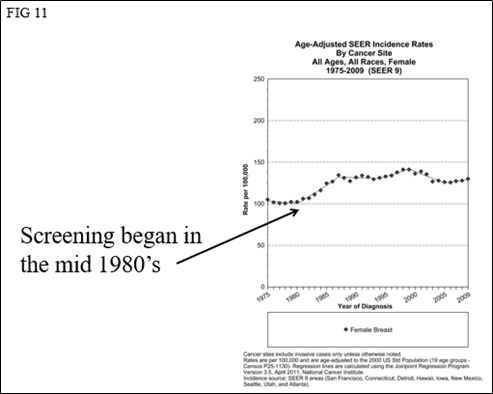
筛查是在1980年代中期在美国开始的(没有国家级计划,因此未进行协作)。参见图11。
患病率的高峰始于1980年代中期,但随着越来越多的女性开始参与筛查,美国的患病率高峰期延长了很多年(图12)。
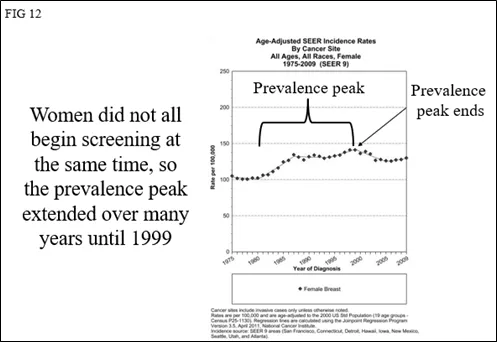
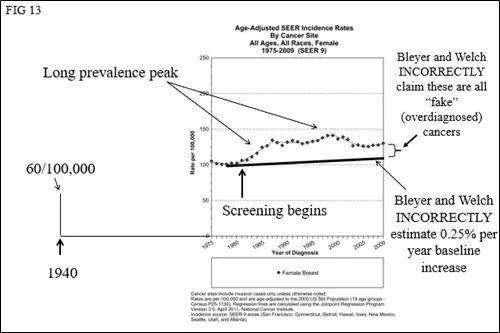
图13显示了Bleyer和Welch如何通过忽略事实数据,错误地描述了美国乳腺癌情况:筛查开展之前,乳腺癌发病率每年稳步上升。这导致了他们做出错误的结论,即对“假癌症”进行了大规模的“过度诊断”(图13)。
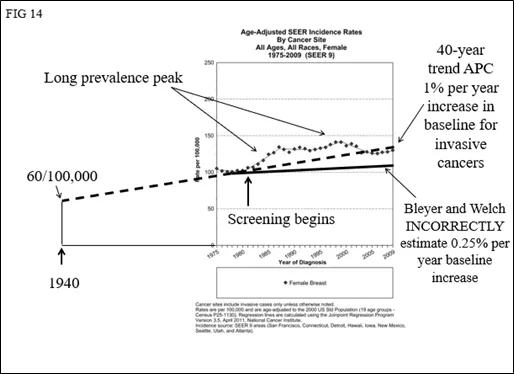
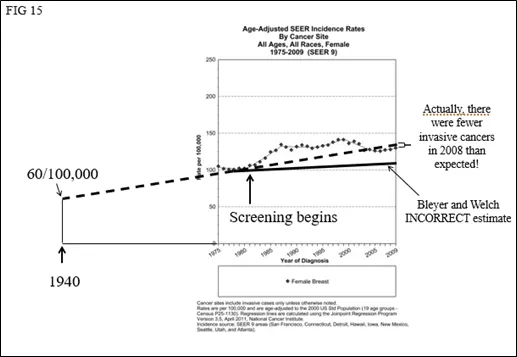
如果他们使用APC为1-1.3%的实际数据,将发现浸润性癌症的实际发生率实际上比预期的要少(图14)。不仅没有“过度诊断”,而且在过去的几年中从人群中去除DCIS数据,可能显示浸润性癌症的发病率实际在下降(图15)(Kopans DB. Arguments Against Mammography Screening Continue to be Based on Faulty Science. The Oncologist 2014;19:107–112) 。
了解乳腺癌筛查的重要性和影响需要准确的数据。医生们和女性们,被一个错误所误导。这个错误就是:未坚持科学,未坚持实证,未理解基本原理。
1) 2021-4-4 乳腺X射线摄影(筛查)先于乳腺超声(诊断)
人群中正在发生成长的乳腺癌数量,远多于每年被诊断出的乳腺癌数量
多年前我们开发了一个非常简单的肿瘤生长模型,可以解释许多观察现象(1)。它解释了,比如,磁共振成像(MRI)这样的检查为何能够比乳腺X射线摄影检测出更多的乳腺癌(2)。它也解释了为什么年轻女性的乳腺癌往往生长更快并且更具侵略性。如果我们假设癌症细胞数量翻倍的时间为:快速增长的癌症60天,中度增长的癌症120天,慢速增长的癌症180天甚至更长。因为形成1毫米大小的肿瘤需要约100万个肿瘤细胞,如果所有癌症都从“原位”生长,则从单个细胞发展到2厘米大小,乳腺临床检查可测的癌症可能需要10至30年的时间:中度生长癌可能仅需20年即可达到2厘米,而快速生长的癌症可能只需要10年即可变成2厘米。如果我们假设,在广泛开展乳腺癌筛查之前,每年的乳腺检查,癌症都在2厘米左右被发现。这意味着,为了维持实际观察到的临床明显的癌症年发病率,人群中必然存在数量众多的、尺寸较小的、正在生长而未发现的癌症。
好的消息是:癌症转移与癌细胞数量相关。这是观察统计结果,有些已经转移的癌症尺寸很小,小到乳腺病理切片中都无法发现;而在另一端,也存在很大的癌症肿瘤,但完全局限于乳房之内未转移。大多数癌症在这两个极端之间发展:癌细胞越多,其成功转移的可能性就越大(3)。通常,癌症在确诊时越小,其尚未转移的机会就越大,可以治愈的机会也越大。
我们如何知道早筛可以挽救生命?
“随机对照试验”(RCT)是专业人士们所认同的,证明某种干预有无临床获益的唯一方法。以死亡率为终点的随机对照试验消除了影响观察分析的偏见因素。关于乳腺癌筛查,成千上万的女性被随机分为两组。如果分配确实是随机的,并且参与者的数量足够多,那么如果无任何措施,两组中将有相同数量的女性患乳腺癌,也有相同数量的女性死于乳腺癌。在乳腺癌筛查随机对照试验中,一组接受检查干预(筛查组),而另一组接受“常规”护理(对照组)。如果接受检查的人群中最终死于乳腺癌的女性人数减少,且差异“具有统计显著性”,则该检查降低死亡的能力将得到“证明”。
乳腺癌影像学领域中,乳腺X射线摄影(Mammography)是唯一经过随机对照试验的技术。纽约健保计划显示,与未进行检查的女性相比,乳腺临床检查(CBE,触诊)实际上也可以挽救生命。但随后的乳腺X射线摄影筛查试验证明,乳腺X射线摄影可以更早阶段发现癌症,可以进一步降低乳腺癌死亡率。
乳腺X射线摄影筛查是乳腺癌早期发现的金标准,因为它是唯一被随机对照试验直接验证可以降低乳腺癌死亡率的技术。我可以断定:用超声筛查也能导致乳腺癌死亡人数有些下降,有些在乳腺X射线摄影上不明显的癌症,用超声可以发现它们。也许乳腺癌筛查的最佳方法是MRI,它可检测出在乳腺X射线摄影或超声中不明显的乳腺癌。但是MRI成本很高,设备有限,需要静脉注射钆造影剂,而且MRI也从未在随机对照试验中进行过测试验证。
筛查VS诊断
Moskowitz在多年前就写道“筛查不是诊断”,这是最为根本重要的一点(4)。一个渔网非常擅长捕捞鲱鱼,但捕捞中也会捞到其他鱼类,所以必须对捕获物进行“分类”,去除其他鱼类而只保留鲱鱼。“筛查”就是渔网捕捞;“诊断”就是对捕获物进行分类。
实际上,乳腺X射线摄影是一种极其出色的“筛查”检查,但它并非很好的“诊断”检查。在筛查层面,乳腺X射线摄影能够非常有效且高效地发现病变,其中许多被证明是可以治愈的癌症;在诊断层面,它也会发现其他非癌症的“东西”,但不一定能很好地区分癌症或非癌症。实际上,使用乳腺X射线摄影的唯一原因是:乳腺癌筛查,在可能治愈的阶段及早发现乳腺癌。
乳腺X射线摄影是唯一被证明可以挽救生命的乳腺癌筛查检查。实际上,可以说筛查是乳腺X射线摄影的唯一作用。乳腺X射线摄影的主要用途(也许是唯一用途)是用于检测乳房中的病变,其中许多是早期癌症。但是,其作为“诊断”的作用有限。对于引起关注的病变,乳腺X射线摄影通常不足以区分良性与恶性,仍需组织学病理诊断,例如,它无法将囊肿与实性肿块区分开。
令我惊讶的是,医生用超声进行乳腺癌筛查,之后用乳腺X射线摄影做进一步评估。更有意义做法是:用乳腺X射线摄影进行筛查,之后用超声评估乳腺X射线摄影的发现。乳腺X射线摄影对筛查非常有效,但诊断用途不理想。它在乳腺中发现“东西”,其中许多东西被证明是早期乳腺癌,但几乎不独立用于作为评估病变是良性还是恶性的诊断。
另一方面,超声是一种出色的“诊断”检查,因为它可以将简单(良性)囊肿与乳房的实体病变区分。有一些癌症在乳腺X射线摄影中不如在超声检查中明显。但乳腺超声的“特异性”比乳腺X射线摄影检查更低:召回率(需要进行额外评估的女性)方面,超声召回率比乳腺X射线摄影高得多,人们对此表示极大担忧。
为何乳腺X射线摄影是主要的筛查检查
乳腺X射线摄影在世界范围成为主要筛查方法的主要原因是:随机对照试验直接证明,乳腺X射线摄影筛查可以挽救40-74岁(参与试验女性的年龄)的生命。关于乳腺X射线摄影筛查的临床试验反复证实了这点。我们了解其优势和局限:
· 可以用来有效地,且高效地进行大规模乳腺癌筛查
· 借助数字技术,影像可以被传输到世界各地被许多专家阅片
· 检查已经完全标准化和自动化,不像超声检查对操作者高度依赖
乳腺X射线摄影在所有乳腺评估的技术中具有最高的空间分辨率,这是检测“微钙化”的最佳方法。“微钙化”是导管原位癌(DCIS,最早形式的乳腺癌)的主要检测方式。DCIS的重要性仍然是一个主要讨论话题,但从确立乳腺X射线摄影筛查以来,浸润性乳腺癌发生率和乳腺癌死亡率已经普遍下降。浸润性癌症的发生率和乳腺癌死亡率可能会继续下降,一定程度上是由于乳腺X线摄影筛查发现处理了DCIS所致(5)。许多浸润性癌症具有DCIS的成分。由于相关DCIS中的微钙化,近20%的浸润性乳腺癌因此被检测到。这是乳腺X射线摄影作为筛查首选的另一个原因。
随着数字乳腺体层合成(DBT)的发展,乳腺X射线摄影作为筛查的性能不断提高(6,7)。DBT可发现额外的癌症,那些在2D乳腺X射线摄影中被重叠的乳腺组织所隐藏的癌症;同时DBT可以降低召回率。DBT不同寻常的优势在于:同时提高了乳腺癌检测的敏感度和特异性(通常敏感度升高伴随着特异性下降,反之亦然)。
底线
乳腺X射线摄影筛查是唯一被随机对照试验证明可以挽救生命的检查。它经过高度发展和标准化,促进有效果且高效率大规模乳腺癌筛查。这种筛查是必要的,因为我们尚无法准确预测谁将发展为乳腺癌,谁不会发展为乳腺癌。绝大多数患乳腺癌的女性并无已知的乳腺癌风险因素。
如果经费资源无限,设备容易获得,且钆造影剂在人体的积累没有后遗症,那么以通过静脉造影剂进行MRI是检测大多数可治愈的乳腺癌的最佳方法。静脉注射碘造影的双能乳腺X射线摄影(所谓的“乳腺能谱成像”)能否提高乳腺癌检测还有待观察。如果可以用DBT设备上结合超声进行筛查,则可以同时进行两种影像的收集,并且通过使两者图像完美配准,大大促进两项技术单独使用和结合使用的性能研究评价。
目前,乳腺癌筛查最佳方法是数字乳腺体层合成Digital Breast Tomosynthesis(DBT)。
参考文献
1. Kopans DB,Rafferty E, Georgian-Smith D, Yeh E, D’Alessandro, H Moore R, Hughes K, Halpern E. A Simple ModelOf Breast Cancer Growth May Provide Explanations For Observations Of Apparently Complex Phenomena. Cancer 2003;97:2951-2959.
2. Kuhl CK, StrobelK, Bieling H, Leutner C, Schild HH, Schrading S. Supplemental
3. Breast MR Imaging Screening of Women with Average Risk of Breast Cancer.Radiology. 2017 May;283(2):361-370.
4. Michaelson JS, Halpern E, Kopans DB. Breast cancer: computer simulation method for estimating optimal intervals for screening. Radiology. 1999 Aug;212(2):551-60.
5. Moskowitz M. Screening is Not Diagnosis. Radiology 1979;133:265-267.
6. Kopans DB. Arguments Against Mammography Screening Continue to be Basedon Faulty Science. The Oncologist 2014;19:107–112.
7. Wu T, StewartA, Stanton M, McCauley T, Phillips W, Kopans DB, Moore RH, Eberhard JW,Opsahl-Ong B, Niklason L, Williams MB. Tomographic mammography using a limited number of low-dose cone-beamprojection images. Med Phys. 2003;30:365-80.
8. Kopans DB.Digital breast tomosynthesis from concept to clinical care. AJR Am J Roentgenol. 2014 Feb;202(2):299-308.


