数字乳腺X射线摄影术的发展简史
介绍
如果此文遗漏了一些在数字乳腺X射线摄影发展中起到重要作用的人,我深表歉意。与许多发展进步的历程中一样,几乎总是存在有些人做出了重要贡献,但并没有得到应有的认可。我会尽我所能提供亮点,但我确信这远不是一个完整的故事。
乳腺X射线摄影发展简史
有两篇回顾乳腺X射线摄影发展历史的文章非常好。一个是Bassett和Gold在《Radiology》发表的文章(1),另一个是Joe和Sickles的文章(2)。
乳房的X射线成像是在伦琴首次发现“X射线”后不久进行的。在20世纪初,德国的Salomon对数千例乳房切除手术样本进行了X射线检查。美国的Stafford Warren对乳房X光片上正常乳房的外观进行了分类。Lockwood和Gershon-Cohen也为了解乳房的X射线图像做出了贡献。Leborgne在20世纪50年代进行了乳腺X射线摄影,显然,他是第一个认识到微钙化与癌症的关系。最后,在1960年,Egan描述了一种乳腺X射线摄影的方法,使该技术标准化,并为乳腺X线摄影的阿系统化和可重复性提供了机会(3)。
20世纪60年代,放射科医生Phillip Strax与生物统计学家Sam Shapiro合作,采用Egan的方法,在纽约健康保险计划(HIP)内进行了第一个乳腺X射线摄影筛查的随机对照试验,该试验中使用的是平面工业胶片,但已经能够显示早期检测可以挽救生命。
普通X射线胶片需要高剂量才能成像,而且对比度也不是很好。当时没有对乳房进行压迫,所以较薄的乳房前部经常被过度曝光并图像饱和,以至于看不到多少信息;而较厚的乳房后部则经常曝光不足,并受到散射X射线的影响。总之,这些图像质量相当糟糕。
在20世纪70年代,John Wolfe与施乐公司(Xerox)合作,利用他们的文件复印的材料技术,对软组织进行X射线成像。这项技术使用了一块涂有硒的铝板。将板放置在绝缘盒中,可在板表面施加高压。穿过乳房的X射线按照到达板上每个点的X射线的比例对板进行放电,留下一个电荷图像。


将印版从盒子中取出,然后将墨粉颗粒施加到印版上,静电荷使颗粒与X射线在其表面留下的电荷成比例地粘附在印版上。
使用塑料涂层的印版,将墨粉融化到其表面,形成“静电复印”,这一基本原理是当今全景数字探测器的基础(只是数字探测器不用墨粉来显示电荷分布,而是直接从成像板上读取电荷)。 尽管静电摄影的图像远优于普通胶片,但它仍然需要相当高的辐射剂量,Bailar在70年代的担忧(4)为降低辐射剂量提供了动力。这直接推动了与单面乳胶膜相结合的荧光屏的发展,使其能够在较短的曝光时间内获得较低的剂量和高的分辨率。专用的乳腺X射线摄影设备使用压迫力将乳房压扁,形成一个厚度更均匀的实体,以提高图像质量,这使得屏/片组合能够取代X射线干板摄影。在20世纪80年代,通过加入滤线栅减少散射,专用乳腺摄影系统中的屏/片乳腺摄影成为主要的筛查方法,其剂量低于以前单独使用胶片的剂量。
计算机时代
随着计算机在医学中的应用越来越多,人们努力将其应用于乳腺X射线摄影。在20世纪80年代,我们将屏/片图像数字化,并能够以电子方式传输图像。1993年至1997年期间,我的研究主任Richard Moore展示,我们可以将数字化的乳腺X射线摄影图像发送到地球同步轨道上的卫星上,在太空中来回传输,而不会丢失任何信息。发送和接收一张图像平均需要2.2分钟。
乳腺X射线屏/片被数字化,传输到计算机可以用来帮助放射科医生检测癌症。人们对“计算机辅助检测”(CAD)产生了极大的兴趣,但最终的结果令人失望。在CAD中,我们放射科医生提供了一些案例,用来“训练”计算机学习我们乳腺X射线摄影图像阅片。但最终CAD没有什么帮助。
20世纪80年代,针对身体各个部位的数字X射线成像设备都正在开发研制中。人们做了很多努力用计算机采集这些数字化图像。美国科学和工程公司(AS&E)是一家雄心勃勃的公司。他们制作了一个“飞焦点”原型机,使用一个带有不同准直器的大轮子。准直器将一束X射线准直成一个点。当轮子旋转时,一个X射线“点”以栅格扫描形式在患者的胸部移动,每个穿过身体的X射线点的信号都被一个大型探测器收集。这个方法非常高效,因为每个点上的数据都被采集;但每次扫描都需要相对较长的时间,而且缺乏足够高的空间分辨率。
不同的探测器材料纷纷被设计发明。研究发现,有些磷光体可以被“激发”,当X射线穿过身体某个部位时,其能量水平会升高,然后可以通过激光扫描探测器,在每个点测量并记录其能量。但这种方法被证明不足以对乳房进行成像(5)。

在20世纪80年代初,AS&E公司由Martin Annis博士领导Paul Bjorkholm博士设计了一个极其有效的探测器,用来开发一个线扫描系统原型机。X射线光子被乳房前准直器限束,无用的散射线被乳房后准直器阻挡。X射线光子穿过狭缝和乳腺进入荧光屏的边缘,该荧光屏的倾斜方向与X射线束平行。一个光电二极管阵列沿着X射线路径,这样就有一个长长的路径让光子被吸收并产生可见光;而可见光到光电二极管的路径很短,这样就大大减少了光扩散,从而产生一个清晰的图像。该装置具有非常高的分辨率,并几乎完全的抑制了散射。
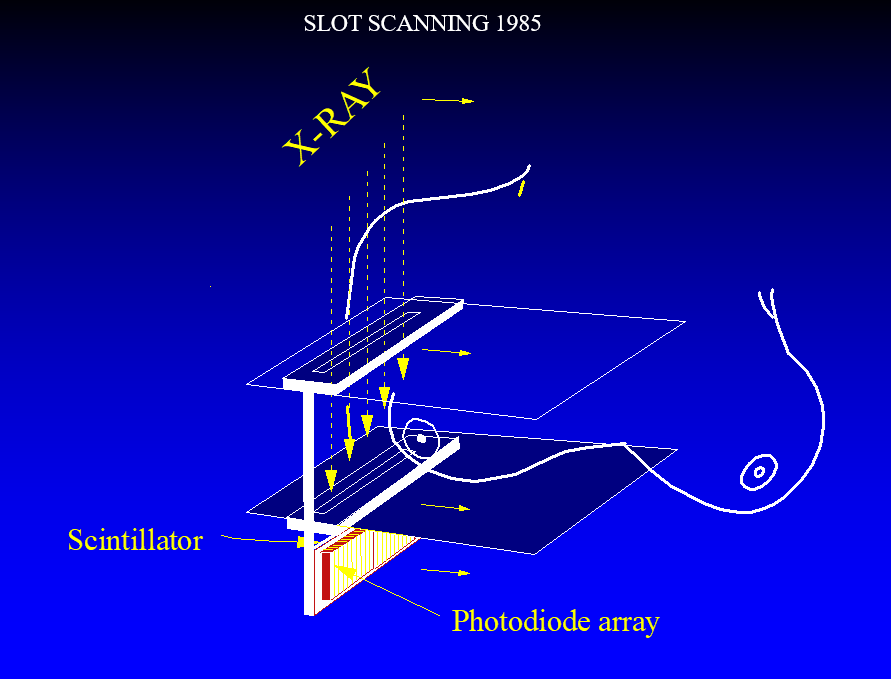
马萨诸塞州总医院(MGH)安装了这样一个原型机,我们获得了志愿者的第一张高分辨率数字乳腺X线影像。不幸的是,该系统过于超前,AS&E无法持续此技术,终止了其开发。
20世纪80年代末,用于人体其他部位成像的X射线系统正在开发中。FDA只需要一个510K流程就可以批准这些系统。510K基本要求是,例如你用传统的屏/片成像获得一个胸部X射线,并与用新的数字胸部X射线设备获得的第二个图像进行比较。通常只需要进行少量影像的比较,在这些比较中,只要屏/片图像和数字摄影影像足够相似,FDA就会批准新的数字系统。
不幸的是,FDA对全景数字乳腺摄影术(FFDM)的批准却明显延迟。因为一位非医生的行政人员,一贯反对乳腺X线摄影筛查;当他从NIH转到FDA任职,并说服FDA,FFDM是一项非常新的技术,放射科医生将无法对之进行解读,需要召回更多女性进行额外评估。他不是放射科医生,这简直是无稽之谈,但结果鉴于公众对乳腺X射线摄影的高度关注,FDA要求FFDM必须经过非常详细、复杂和昂贵的程序,即所谓的上市前批准(PMA),PMA通常是给全新技术的注册途径,很少有公司有足够的资源或兴趣接受这种方式,FFDM系统的发展因此被大大推迟了。
1992年,Etta Pisano医生组织了数字乳腺摄影技术开发组,该小组后来成为国家数字乳腺摄影技术开发项目组,最终发展成为国际数字乳腺摄影技术开发组。这个开发组最初由我在麻省总医院的小组组成,包括Richard Moore和一位刚刚加入我们的物理学家Loren Niklason博士,来自费城Thomas Jefferson医学中心的Stephen Feig医生、以及来自加拿大的Martin Yaffe博士和Donald Plewes博士。我们的任务是帮助GE和Fisher Imaging公司开发他们的FFDM原型机。
乳腺X射线摄影的数字探测器概述
Yaffe和Mainprize在一篇论文中详细介绍了为乳腺X射线摄影开发的各种探测器(6)。Fisher Imaging设计了一个线扫描系统,该系统使用一条准直的X射线,通过机械方式扫描整个乳房,探测器与该光束对齐,通过乳房前后的狭缝减少散射。探测器由磷光体探测器阵列组成,其中X射线被转换为电信号。这与AS&E系统类似,但光电二极管阵列与X射线束一致。阵列和准直光束在整个乳房进行扫描。最终,这个系统过于复杂,没有成功商业化。
通用电气公司开发了一种平板探测器,由在光电二极管阵列上以柱状外延生长的碘化铯晶体组成。碘化铯将X射线光子转换为可见光光子,光子由光电二极管转换为阵列中的电信号。这个最初是一个用于血管造影的数字探测器,他们希望将其应用扩展到乳腺X射线摄影。
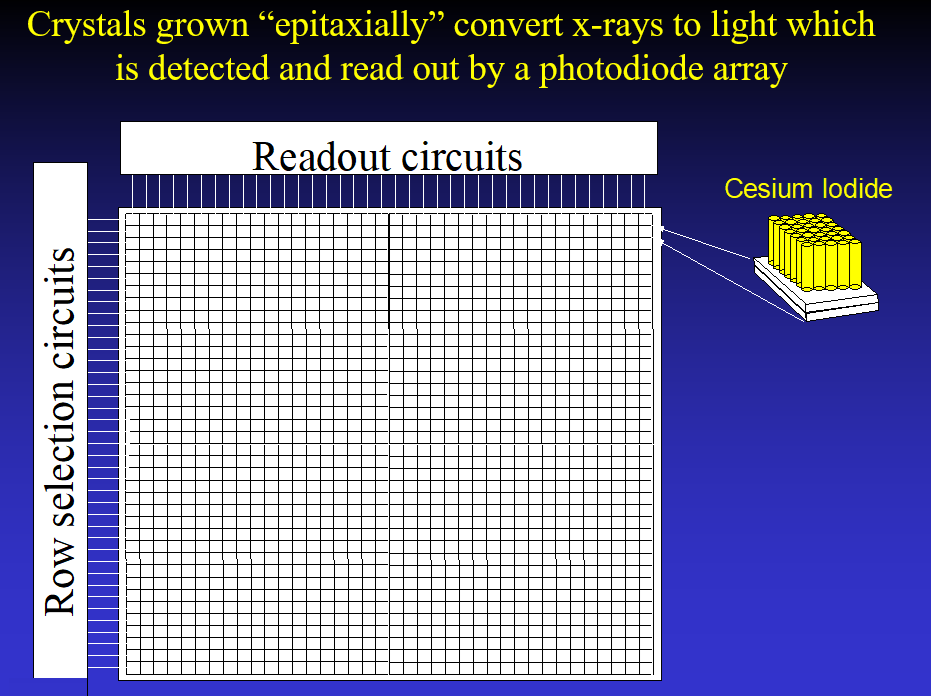
我在20世纪70年代就读过断层合成的概念,并意识到它可能对乳腺摄影有很大的优势(7),然而我一直等到20世纪90年代才获得第一台数字乳腺摄影原型机。为了开发数字乳腺提层合成(DBT),我们需要一个高分辨率的系统,而且该系统能够足够快地读出数据,使我们能够在短时间内拍摄多张图像。GE探测器具有这些特点,因此我们在数字乳腺摄影技术开发组内与GE合作,帮助他们开发FFDM,并获得他们的探测器使用。
一个早期的FFDM系统是基于Bennett公司和Northrop Grumman公司开发的探测器,这种探测器的成像视野很小,因此该系统在市场上定位为用于“点压”成像。1994年,Bennett公司获得了美国FDA的批准,在许多玻璃纤维的末端涂上磷光体涂层,该涂层从大约5平方厘米的面积逐渐变细,直至将光子转换为电信号的带电耦合器件。
LORAD(后来被Hologic并购)开发了基于CCD探测器的系统。先是Trex公司尝试将多个CCD探测器拼接为一个探测器,但该系统没能获得FDA的批准。类似技术在Hologic公司获得成功,通过将12个小面积CCD探测器(4x3阵列)合成为一个探测器获得大面积成像视野,该系统并获得FDA批准。但是此上市时间很短,因为Hologic很快改用了非晶硒探测器。现在很多数公司在使用这非晶硒探测器,而GE公司仍在使用其碘化铯非晶硅探测器。
非晶硒探测器是基于20世纪70年代和80年代早期的干板摄影系统:非晶硒与金属融合,形成一个半导体板。均匀的电荷被放置在探测器表面上,穿过乳房的X射线按任何一点上撞击板的辐射量的比例对板进行放电。不像干板摄影法那样,现在不是将墨粉吹到印版上以显示潜影,而是直接从印板上读取电荷。
FDA要求进行上市后筛查研究
FDA继续阻碍FFDM的推广,不仅要求PMA,而且还要求FFDM产品获得批准的公司进行大规模的上市后筛查试验。这对开发癌症治疗方法的公司来说并不罕见,但对医学影像行业来说却是闻所未闻。据报道,时任Fisher Imaging公司负责人Morgan Nields前往国会解释,他的小公司无力承担大规模的上市后试验,而国会专门拨款2500万美元来支持这些试验。2000年,GE公司向FDA提交了FFDM产品的PMA申请。我以独立人身份地参加了FDA咨询委员会的会议,当时该委员会正在审查GE的申请。我作证说,FDA不应该要求FFDM的PMA,因为它显然等同于屏/片乳腺X射线摄影。我展示了一个乳腺癌病例分别在FFDM和屏/片系统的图像,并向委员会解释,我看不出有何不同,当然他们也看不出何不同。 我们理解影像物理学,FFDM和屏/片图像看不出差异,所以FFDM应该被批准。我解释说,FDA不应该要求进行PMA,以及批准后的筛查试验也没有必要(8)。最终委员会接受了我的观点,一致支持GE的PMA,并且建议FDA放弃对批准后筛查试验的要求。FDA最终同意了GE的PMA,并放弃了上市后试验要求。
不幸的是,我怀疑国会专项拨款的,已经不再需要的2500万美元被用于了DMIST试验(9),而DMIST试验实质上做的是FDA已经放弃要求的上市后筛查试验。这笔资金被浪费了。尽管有人声称,DMIST显示对于某些女性,FFDM优于屏/片系统,但总体研究表明,FFDM和屏/片系统临床性能是相当的。FFDM的真正优势在于临床流程方面的巨大变化:不再需要化学品和胶片处理了,也不再需要胶片库和胶片管理了。图像将永远不会丢失,并且可以在世界任何地方被不限个数的阅片者同时浏览。也许最重要的是,FFDM为数字乳腺体层合成(DBT)的发展打开了技术之门,DBT极大地提高了可治愈乳腺癌的检测率。尽管计算机辅助检测(CAD)没有实现其最初的承诺性能,但下一个进展“人工智能”(AI)几乎肯定会成为乳腺癌早期检测的一个重大改进。FFDM还支持双能减影应用,即所谓的“能谱乳腺摄影”,现在正被用于检测乳腺癌的新生血管(10)。
X射线乳腺摄影技术一直在稳步发展,从普通胶片到干板摄影,到屏/片系统,然后是数字乳腺摄影,这些都是渐进式的改进。直到DBT诞生,在检测微小的、可治愈的浸润性癌症方面取得了重大进步。现在,计算机化乳腺影像已经取代了屏/片乳腺影像,比如将乳腺超声引入DBT系统,提供DBT/超声融合图像,以进一步提高在乳腺癌生长的可治愈阶段将其检出的能力。乳腺双能减影还可用于提高我们对簇状微钙化的检测,这些微钙化是原位乳腺导管癌(DCIS)征象,有时是与浸润性乳腺癌相关的唯一迹象。注射碘化造影剂以显示癌症的新生血管后的双能量减影也将加强对处于早期和潜在可治愈阶段的癌症的检测。
自1990年以来,我们已经将乳腺癌的死亡率降低了近50%,这在很大程度上是因为早期发现。拥有可以由计算机使用人工智能进行分析的数字图像,将使我们能够利用计算机进行早期检测,并应提高我们的能力,在可能治愈的时候有效地检测更多癌症,并进一步减少乳腺癌死亡。
REFERENCES
1. Bassett LW, Gold RH. The evolution of mammography. AJR Am J Roentgenol. 1988 Mar;150(3):493-8. doi:10.2214/ajr.150.3.493. PMID:3277343.
2. Joe BN, Sickles EA. The evolution of breast imaging: past to present. Radiology. 2014 Nov;273(2 Suppl):S23-44. doi:10.1148/radiol.14141233. PMID: 25340437.
3. Egan RL. Experience with mammography in a tumor institution. Evaluation of 1,000 studies. Radiology.1960 Dec;75:894-900. doi:10.1148/75.6.894. PMID: 13725888.
4. Bailar, JC. Mammography: A contrary view. Ann Intern Med 1976 84:77-84.
5. Oestmann JW, Kopans DB, Hall DA, McCarthy KA, Rubens, JR. A comparison of Digitized Storage Phosphors and Conventional Mammography in the Detection of Malignant Microcalcifications. Invest. Rad. Vol. 23 No. 10 1988; 725-728.
6. Yaffe M, Mainprize J. Detectors for Digital Mammography Technology in cancer research & treatment, 2004-08, Vol.3 (4), p.309-324
7. Kopans DB. Digital breast tomosynthesis from concept to clinical care. AJR Am J Roentgenol. 2014 Feb;202(2):299-308.
8. https://essaydocs.org/radiological-devices-panel-meeting.html
9. Kopans DB. A history of DMIST and its implications - Limited resources should be better spent. Clin Imaging. 2021 Jun 17:S0899-7071(21)00251-5. doi:10.1016/j.clinimag.2021.06.005. Epub ahead of print. PMID: 34172355.
10. Lewin JM, Isaacs PK, Vance V, Larke FJ. Dual-energy contrast-enhanced digital subtraction mammography: feasibility. Radiology. 2003;229:261-8.


