数字乳腺体层合成(一)
引言
数字乳腺体层合成(DBT)是乳腺X线摄影筛查的一个重大进展。20世纪70年代计算机的引入以及20世纪80年代和90年代数字成像技术的发展为改进放射学评估带来了重大机遇。在美国,由于食品和药物管理局(FDA)要求制造商进行耗时且昂贵的上市前批准(PMA)过程,而不是简化的510K路径(其他数字成像产品,如骨骼、胸部等,上市只要满足510K要求就可以),因此全视野数字乳腺X线摄影(FFDM)的开发被推迟。尽管缺乏支持,我们于1992年开始在马萨诸塞州总医院(MGH)开发数字乳腺体层合成(DBT)技术,但直到2011年,FDA才签发了第一个DBT产品的PMA申请,批准其应用于临床。此后,由于其优势显著,DBT在美国逐渐取代2D FFDM。
数字乳腺体层合成(DBT)的发展
1978年,我成为MGH“放射照相部”负责人。除了X射线之外,我们还开始使用超声和其他成像测试来评估乳房,因此我将部门命名为“乳房成像”(Breast Imaging),这最终成新的亚专业,在世界各地被采用。
当我们在乳腺X射线图片上发现一些引起关注但无法触及的东西时,我们会在图像的引导下将导丝插入乳房(“导丝定位”),引导外科医生到该区域,以便切除病变并确定其良恶性(我本人制定了乳腺导丝定位的临床指南)。外科医生会把手术室切除的组织送来给我们做X光检查,以确认目标病变已经被切除。令我震惊的是,切除下的标本在X光图片上的病变显示比乳腺X射线图片上清晰得多(图1)。
当然,部分原因是标本离探测器更近,因此几何距离造成的模糊减少了。但很明显,乳腺X射线片上病变前后的乳腺组织隐藏了病变。这被物理学家称为“乳腺结构噪声”。通过去除叠加在病变上的组织,其形状和边缘都比二维乳腺X射线片清晰得多。

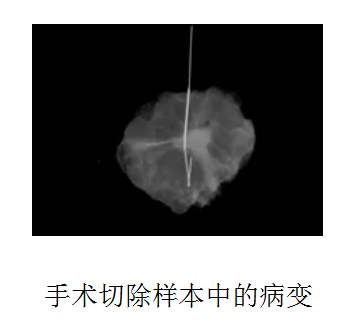
![]()
图1
在20世纪70年代,我们尝试采用线性和多环形运动方式的断层扫描来评估肺部、肾脏和其他器官。在曝光时,X线球管与影像接收装置(当时就是屏片)作相反方向移动,移动的轴心在目标层面上,从而使该层面的结构清楚的显影,而目标平面前后相邻的组织结构则因球管和探测器的运动而变成模糊影像。通过改变支点和重复曝光,整个组织的“切片”(或平面)都可以通过“向上或向下”逐层获得目标层面而完成,而且通过模糊前后相邻层内的组织,使目标层内的组织结构清晰度更高。
然而,在20世纪70年代,Bailar提出了一个担忧,即乳腺X射线检查的辐射可能会导致更多的癌症,这种担忧,激发了低剂量乳腺X射线检查的发展(屏片系统代替了干板照相系统),但也被用来反对对40多岁的女性进行筛查。幸运的是,我们现在知道,随着年龄的增长,乳腺的辐射风险会迅速下降,而且没有直接证据表明乳腺X线筛查对40岁及40岁以上的女性有风险,即使是使用外推法进行风险评估,其风险也远低于最小的收益(1,2,3,4,5,6),但当时不可能推进更高剂量的X射线乳腺成像技术。因此,甚至不可能建议使用当时的常规体层摄影术(Tomography)进行乳房评估,因为每个切片(或平面)都需要进行一次完全曝光,因此提供整个乳房的“切片”图像需要多个完全曝光来,这样做辐射剂量会显著提高。
偶然地,我看到了Miller等人的一篇论文,其中描述了一种技术,在不增加剂量前提下的提供整个乳腺的"切片"图像(7)。“体层合成”似乎提供了我正在寻找的机会。
视差是体层摄影背后的基本原理
简单说,体层摄影依赖于视差。当探测器上方的物体获得X射线,然后移动X射线管以从不同角度对物体成像时,物体在探测器上的投影(阴影)将随着X射线源的移动和探测器上方物体的高度而移动。距离探测器较远的结构“阴影”在探测器上的移动似乎比距离探测器较近的结构“阴影”移动得更远。
我们将从不同角度拍摄的标准乳腺X射线摄影图像应用于乳房体层合成。图2a、b、c示意性地显示了其工作原理。X线球管在乳房上方以一个弧形移动,从不同角度分别拍摄三张图像。请注意,“组织阴影”在探测器上移动的距离比靠近探测器的癌症阴影要长。
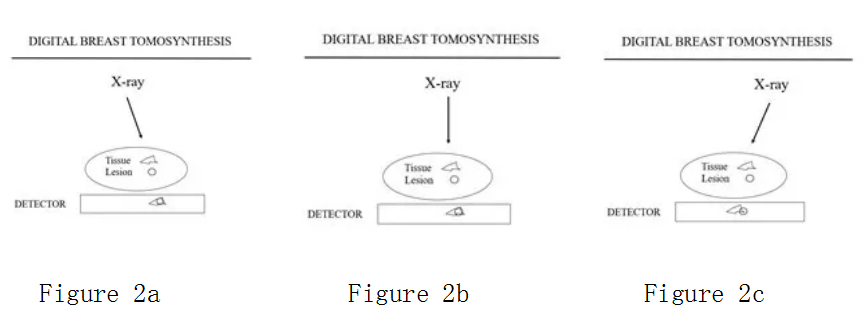
通过从不同角度拍摄多幅图像,可以使用计算机对图像进行对齐,从而使探测器上方所需平面中的结构精准配准,并且它们的“阴影”将通过所有投影相互增强。同时,目标平面外的结构图像将因为配准误差而不被增强,并且它们将在背景中淡出。
图3.计算机对齐图像,使感兴趣的平面得到加强(在本例中为3次)并清晰可见,而平面外信息则因为配准误差并淡入背景中。在第一个系列(图3a)中,图像对齐,使包含“组织”的平面在所有3个图像上配准并增强,同时“癌症”因为配准误差并淡入背景。
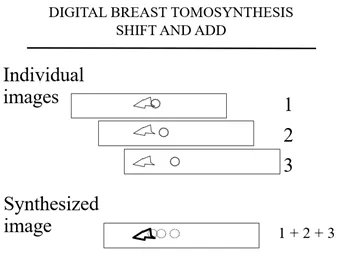
图 3a
包含三角形组织的平面具有清晰的细节,而癌细胞则因为在平面外淹没在背景中。
然后,计算机将图像位移并再次将他们相加,这一次(图3b),癌症图像变得锐利,而“三角形组织”淡入背景。
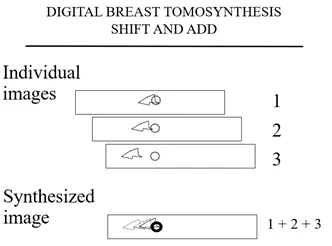
图 3b
体层合成不同于之前描述的体层摄影,因为每个体层合成投影图像的剂量只相当于一小部分完全曝光FFDM剂量。整个乳房的任何层面都可以从少数投影图像中获得。
体层合成的优点是层面可以具有投影图像的全分辨率。X轴和Y轴方向的细节仅受常规系统分辨率的限制。有些人将DBT称为“3D 乳腺X线摄影”,但这并不准确。其“体素”(voxel)不是立方体。取决于移动X射线源以获得投影图像的角度,获得投影图像的角度越小,Z轴方向的不确定性越大,因此采集角度越窄,切片越“厚”。获得真正3维图像的唯一方法是像锥形术CT那样让X射线源旋转角度超出180度,而这对乳房在乳腺X线摄影系统中的位置显然不适用。
DBT系统各有不同
与其他任何X线系统一样,DBT系统的设计和图像质量各不相同。探测器目前有两种主流商用探测器。GE使用其专有探测器,柱状碘化铯闪烁体在探测器表面,将X射线吸收转换为可见光,然后将光能转换为电信号。另一种主流探测器使用非晶硒技术。这与多年前用于乳腺X射线摄影的干板X线摄影所用材料非常相似。探测器平板表面具有均一的电荷。X线曝光导致薄膜放电,其放电量与入射每个像素的X线剂量成正比。然而,该探测器不是通过在充电板上喷碳末方式(和干板X线摄影一样)成像,而是直接从探测器以电子方式读取剩余电荷。X线信号直接转换为电信号。探测器的像素大小不同,因此它们的空间分辨率也不同。
采集角度
不同的商用系统,X线球管(源)旋转角度不同。X线球管不必在乳房上方旋转一个大弧线来产生体层合成图像。看起来15度扫描就可以提供出色的图像。然而,理论上,角度越大,Z轴分辨率越高。关于最佳采集角度和采集的投影图像数量,虽然一直有理论和实验角度的建议,但由于没人做过直接比较这些主流系统的大型临床研究,因此最佳采集角度是什么,最佳采集图像数量是多少依然不明确。
如何获得最佳的投影图像
Richard Moore是我们开发DBT时MGH乳腺成像研究的负责人,他首先提出在乳房上方以阵列形式使用多个X线球管并依次发射以生成投影图像。其优点是,由于球管是固定的,不会移动,因此不存在运动导致不清晰的可能性,图像采集速度仅与探测器的读取图像速度有关。据我了解,这一办法正再次被考虑。
连续运动
一些制造商决定使X线球管沿着弧线连续运动,同时在弧线固定点上间歇发射X射线。这可能是最有效的方法。唯一的问题是,如果在曝光过程中球管有运动的话,则可能会模糊投影图像。但如果曝光时间足够短,这似乎不是问题。
步进式扫描
另一种正在被使用的方法是球管移动,停止,"发射",移动,停止,发射等。每次曝光时球管停止运动,可消除图像采集过程中的运动,然而,移动一个沉重的X线球管,使其停止并再次移动,这有机械方面的问题。
需要多少个投影图像?
目前还不清楚最佳DBT成像到底需要多少投影图像。每家公司都有自己的方法,但是没有人用同一乳房比较过不同成像系统,所以这些差异只是理论上的。
图像处理
"平移和加法"是处理DBT图像的原始方法。一些制造商采用了“过滤反投影”方法。吴涛博士开发了最大似然迭代算法(8),该技术与其他技术(9)相比具有重大优势。
DBT阅片
每组投影图像重建的层数与乳房的厚度有关。与FFDM 2D阅片相比,阅读每位患者所有层面图像肯定需要更多时间,但正如稍后所讨论的,由于DBT降低了召回率,因此节省的时间可以用来DBT筛查案例阅片。
DBT是一种筛查方法
我们开发了DBT作为筛查的改进方法,以取代(实际上是添加到)2D乳腺摄影术。DBT可以检测更多的早期癌症并降低召回率,但它只是在用于筛查时才能充分体现这点。作为一种“诊断工具”,它的价值有限。早期,工作人员并未意识到DBT的实际价值,仅在女性召回需要额外评估时才使用它。如之前“第2部分”所述,DBT将作为所有女性常规筛查方法来,取代标准2D乳腺X线摄影术。
REFERENCES
1.Feig SA:Hypothetical breast cancer risk from mammography:A reassuring assessment.Breast 5:2-6,1980.
2.Mettler FA, UptonAC, Kelsey CA,Rosenberg RD, Linver MN. Benefits versus Risks from Mammography: A Critical Assessment. Cancer1996;77:903-909.
3.Feig SA, Hendrick RE. Radiation risk from screening mammography of women aged 40-49 years.J Natl Cancer Inst Monogr.1997;(22):119-24. Review.
4.Hendrick RE.Radiation doses and cancer risks from breast imaging studies.Radiology.2010 Oct;257(1):246-53.
5.Yaffe MJ, Mainprize JG. Risk of radiation-induced breast cancer from mammographic screening.Radiology.2011 Jan;258(1):98-105.doi: 10.1148/radiol.10100655. Epub 2010 Nov16.Erratum in: Radiology.2012 Jul;264(1):306.
6.Miglioretti DL,Lange J, van den Broek JJ, Lee CI, van Ravesteyn NT, Ritley D, Kerlikowske K,Fenton JJ, Melnikow J, de Koning HJ, Hubbard RA. Radiation-Induced Breast Cancer Incidence and Mortality From Digital Mammography Screening: A Modeling Study.Ann Intern Med.2016 Feb 16;164(4):205-14.
7.Miller ER, McCurry EM, Hruska B. entitled “An infinite number of laminograms from a finite number of radiographs.Radiology 1971; 98:249-255
8.Wu T,Stewart A, Stanton M, McCauley T, Phillips W, Kopans DB, Moore RH, Eberhard JW,Opsahl-Ong B, Niklason L, Williams MB.Tomographic mammography using a limited number of low-dose cone-beam projection images.Med Phys.2003;30:365-80 which won The Sylvia Sorkin Greenfield Award for two of the best papers (other than Radiation Dosimetry) published in Medical Physics for 2003
9.Wu T, Moore RH, Rafferty EA, Kopans DB. A comparison of reconstructional gorithms for breast tomosynthesis.Med Phys.2004 Sep;31(9):2636-47


