创造“过度诊断”的神话(二)
我有必要花额外时间来阐明“乳腺癌筛查导致大规模的过度诊断”这个错误的说法,因为它被不恰当地表述使用,并且成功地制造出一些影响,限制了乳腺癌筛查的机会。然而它是基于错误的分析,没有任何科学依据。毫无疑问确实乳腺癌患者死于癌症之外的其他原因。但事实上,这也正是乳腺癌早期发现和治疗的目标:不因乳腺癌而过早去世。有些尸检案例显示,确实有一些女性的癌症,即使不进行治疗干预,会死于其他原因,而且她们的癌症不会产生任何临床症状,但这主要适用于老年女性。也可能有一些癌症非常惰性,甚至不会伤害更年轻的女性,但这种情况并不常见;而且即使存在的话,我们目前还无法确定哪些癌症可以放过不做任何处理。现实中最可能的是:给予足够时间,所有乳腺癌都会致命。如前所述,筛查随机对照试验(RCT)已证明筛查和早期检测可减少乳腺癌死亡。1990年以来,美国的乳腺癌死亡率下降了40%以上。而此前死亡率在50年没有变化,鉴于乳腺癌筛查始于1980年代中期,这一事实有力地支持了早发现因而早治疗,对死亡率降低发挥了重要作用。无论如何,鉴于筛查本身不能做出癌症诊断(这是病理学家的职责),也不能决定需要哪种治疗(这是肿瘤学家的职责),将“过度诊断”(如果存在的话)和“过度治疗”(而这实际上是大多数医保项目的基础)归咎于筛查是没有意义的。 “过度诊断”声明的主要错误在于,没有理解乳腺癌的发病率在筛查开始前的几十年一直在增加。
这里有必要再次强调一个之前解释过的主要分析错误。“过度诊断”的主要论点之一是试图预测如果没有筛查,乳腺癌的发病率会是多少,然后将实际发病率与分析人员“猜测”的发病率进行比较。这并非不合理,但问题是,没有可靠的在筛查开始之前的数据,数据外推造成了大规模“过度诊断”的错误概念。在美国,这些分析是基于一种错误的观点:即乳腺癌的发病率在筛查(20世纪80年代中期开始)之前没有增加或只是略有增加。在美国和其他国家,人们曾经认为乳腺癌的发病率多年来没有变化。但这不是事实。在可考数据中,很明显乳腺癌发病率在筛查开始前几十年一直在稳步上升(1,2,3,4,5,6,7,8)
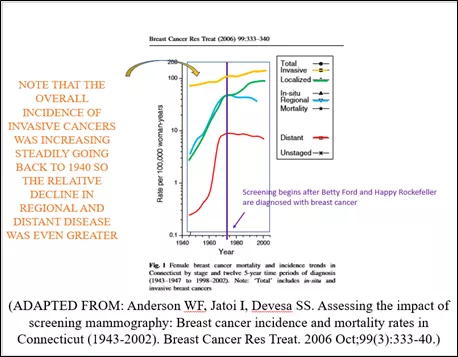
图1
此外,那时美国没有全国性的筛查项目,因此没有全国性的数据跟踪全国范围内的乳腺癌筛查和乳腺X射线摄影的使用情况。因此,分析者在没有直接数据的情况下自由推测乳腺X射线摄影的影响。在美国最接近事实全貌的是始于1974年的国家癌症研究所(NCI)的监测流行病学和最终结果(SEER)项目。SEER现在跟踪来自美国19个地区的数据,覆盖了大约35%的美国人口(9),但令人费解的是,SEER从未追踪记录癌症的检测方法。因此,所有使用SEER数据的分析都假设癌症检查使用了乳腺X射线摄影。由于美国没有有组织的筛查,我们只能估计筛查何时开始以及有多少女性参与。20世纪80年代早期到中期乳腺癌发病率的突然上升(图2)表明,女性在这个时候开始参与筛查。由于没有有组织的筛查,女性并非都是在同一时间开始的,因此有一个很长的“流行高峰”,随着越来越多的女性进行第一次筛查,这一高峰持续了多年。据估计大约20%的女性在20世纪80年代中期进行了第一次乳腺X射线检查,随时间推移,此数字一直在增加,直到1999年左右。在那个时候,患病率高峰结束了。这一事实证明,随着参与筛查,美国大约有70%的女性接受了乳腺X射线摄影后,乳腺癌的发病率随着参与筛查而开始下降(图4)。
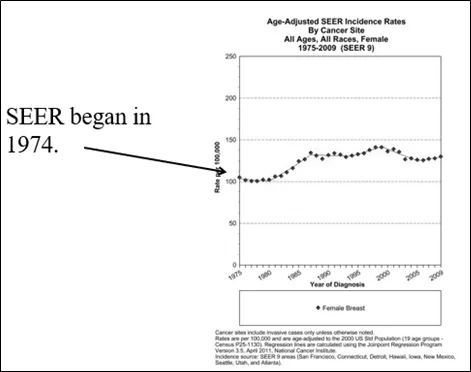
图2:1974年开始的SEER数据。1975年的小幅上升是因美国总统夫人和副总统夫人均诊断出乳腺癌,因此一些女性去接受了筛查(特别筛查),导致当年流行率小幅上升。
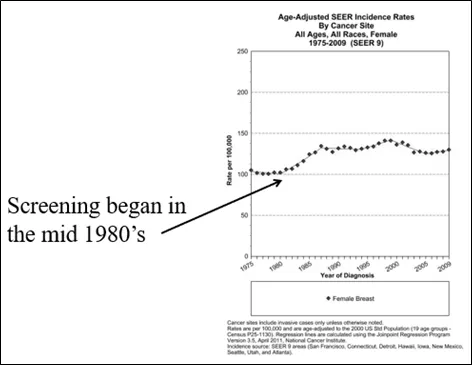
图3 :1980年代中期在美国开始筛查的情况,该报告基于瑞典双郡试验的报告,证明对40-74岁女性进行筛查有益。随着越来越多的女性开始参与筛查,发病率开始上升,形成了一个长期的“流行高峰”,该高峰一直持续到1999年。
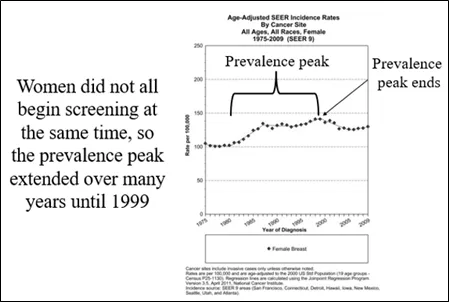
图4:据我们所知,在1999年参与筛查的人数趋于稳定,大约70%的女性定期接受筛查。此时“发病率”开始回落至基线,而基线本身仍在稳步上升,结束了长期的“流行高峰”。
著名的《新英格兰医学杂志》(10)上曾发表一篇文章,其分析声称,乳腺X射线摄影筛查存在大量的“过度诊断”。这篇论文根本不应该通过同行评审,因为作者的整个论点不是基于科学,而是基于他们自己所说的 “最佳猜测”:即如果不是在20世纪80年代中期开始筛查,2008年乳腺癌的发病率会是多少。他们猜测发病率每年只会增加0.25%(图5)。这篇论文的缺陷在于:其中一位作者后来使用同样的数据,写了一篇论文,声称在没有筛查的情况下,乳腺癌的发病率根本不会增加(11)。尽管如此,他们仍然使用0.25%的年增长率(APC)的估计去推断2008年在没有筛查的情况下浸润性乳腺癌的发病率。他们“最佳猜测”结果低于2008年的实际SEER发病率。所以他们认为,由于实际发病率远远高于他们对应该发生什么的“猜测”,多余的癌症肯定是那些通过乳腺X射线摄影发现的,而且这些癌症都不是“真实的”,也永远不会有临床症状。很多层面上看,他们这种推论都是很令人震惊的,因为他们并没有数据证实哪些癌症是通过乳腺 X射摄影检测到。他们认为,明显过多的被“过度诊断”出的癌症,本质上是“假癌症”。
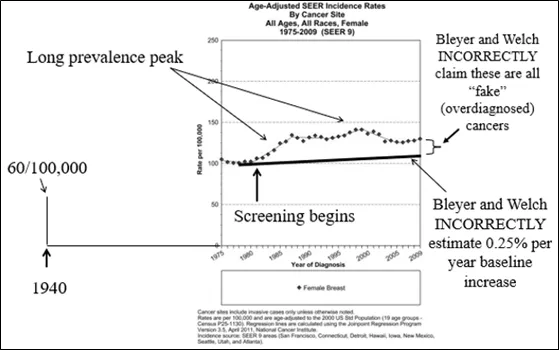
图5:Bleyer和Welch声称如果筛查没有在1980年代中期开始,基线发病率每年只会增加0.25%(深黑色线)。据称,由于实际癌症数量(SEER数据)远高于他们的“猜测”,因此所有超过该线的癌症都是因筛查而被“过度诊断”造成的“假癌症”。
他们的整个论文都建立在他们的“猜测”上,即如果1980年代没有开始筛查,2008年乳腺癌的发病率会是多少。但他们忽略了这样一个事实:康涅狄格州肿瘤登记处在SEER之前收集的数据显示,浸润性乳腺癌的发病率在SEER项目开始之前的几十年里一直在稳步上升。这不是一条平坦的线。增长率不是“0”(在Welch的第二篇论文中),也不是他在与Bleyer博士的论文中估计的0.25%。事实上,在进行任何筛查之前,基线发病率至少从1940年(12)开始就以每年1.0-1.3%的速度增长。上述估计来自康涅狄格州肿瘤登记处。这个数据收集小组自20世纪30年代末开始运作,现在是SEER计划的一部分。数据清楚地表明,自20世纪40年代以来,乳腺癌的发病率一直在稳步上升,从90年代开始,早期癌症的发病率上升,晚期癌症的发病率开始下降(13)。 如果使用正确的外推(图6),不仅没有“过度诊断”,而且乳腺癌的实际发病率低于1980年代中期没有开始筛查时的预期(14)。
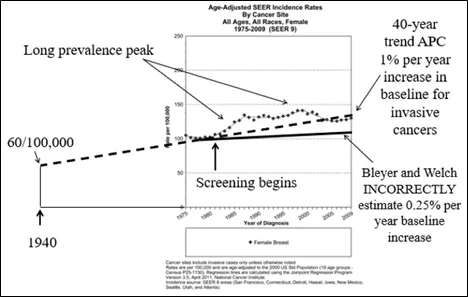
图6:康涅狄格州肿瘤登记处的数据显示,浸润性乳腺癌的基线发病率几十年来一直在稳步上升(虚线)。如果将这一每年增加1%的“基线”发病率(实际可能约每年1.3%)外推,很明显,预期的浸润性癌症数量比2008年实际诊断的要多,Bleyer和Welch观点显然是错误的。虽然无法证明,但这很可能是因为多年来筛查一直在清除DCIS病变,阻止了许多DCIS发展为浸润性癌,这也恰恰解释了两个数据之间的差异。
最重要的是,没有证据表明浸润性癌症有任何严重的“过度诊断”。声称大规模“过度诊断”的论点是基于错误的分析,这些分析没有考虑到浸润性乳腺癌的发病率至少自1940年以来一直在稳步增加这一事实。所有浸润性癌症都有可能发生转移和致命。乳腺X射线摄影能够检测到很多转移扩散发生之前的病变,这样的病变通过治疗完全可以治愈。忽视数据和基于猜测的分析会导致错误的结论下面的数字解释了这些数据是如何被误用来错误地暗示大规模的“过度诊断”的。事实上,不仅不存在大规模的“过度诊断”,而且现在浸润性癌症的发病率比预期的还要低。这可能是因为多年来的筛查已经消除了许多导管原位癌(DCIS)的病例,并且很可能阻止了它们进展为浸润性。这些解读的谬误在之前的DART Board的文章中有概述,文章题目为:为了避免被误导,您需要了解发病率、患病率和年度百分比变化概念(APC)TOAVOID BEING MISLED YOU NEED TO UNDERSTAND INCIDENCE, PREVALENCE, AND ANNUALPERCENTAGE CHANGE (APC)如果我们看看SEER数据:图1-图6。根据康涅狄格州肿瘤登记处可追溯到1940年的数据,我添加了他们在当时(1940年)记录的60/100,000的发病率。如果我们查看最新的SEER数据 (15),我们可以看到基线发病率再次增加,就像筛查开始前的几十年一样。结论乳腺癌的发病率几十年来一直在增加(早在进行任何筛查之前),可能是由于营养改善导致早熟(初潮年龄提前),乳腺组织暴露于雌激素和激素周期的风险增加。此外,女性推迟足月妊娠也会增加患乳腺癌的风险。忽视乳腺癌发病率在筛查开始前几十年一直在上升这一事实,导致了大量“过度诊断”的错误说法。正如Pulitti等人(16)和Duffy等人(17)所解释的那样,“过度诊断”的比率可能低于10%,甚至很可能是“0%”。
REFERENCES
[1]Bray F, McCarron P, Parkin DM. The changing global patterns of female breast cancer incidence and mortality. Breast Cancer Res. 2004;6(6):229-39
[2]Zahl PH, Strand BH, Maehlen J. Incidence of breast cancer in Norway and Swedenduring introduction of nationwide screening: prospective cohort study. BMJ2004;328:921–4
[3]deGlas Nienke A, de Craen Anton JM, Bastiaannet Esther, Op’t Land Ester G,Kiderlen Mandy, van de Water Willemien et al. Effect of implementation of themass breast cancer screening programme in older women in the Netherlands:population based study BMJ 2014; 349:
[4]Sigurdsson K, Olafsdóttir EJ. Population-based service mammography screening: the Icelandic experience. Breast Cancer (Dove Med Press). 2013 May 9;5:17-25.
[5]Jørgensen KJ, Zahl PH, Gøtzsche PC. Overdiagnosis in organised mammography screening in Denmark. A comparative study. BMC Womens Health. 2009 Dec 22;9:36.doi: 10.1186/1472-6874-9-36.
[6]Garne JP, Aspegren K, Balldin G, Ranstam J. Increasing incidence of anddeclining mortality from breast carcinoma. Trends in Malmö, Sweden, 1961-1992.Cancer. 1997 Jan 1;79(1):6974.
[7]http://www.cancerresearchuk.org/cancer-info/cancerstats/types/breast/incidence/#trends last accessed 3/01/2013
[8]Tabár L, Dean PB, Chen TH, Yen AM, Chen SL, Fann JC, Chiu SY, Ku MM, Wu WY, HsuCY, Chen YC, Beckmann K, Smith RA, Duffy SW. The incidence of fatal breast cancer measures the increased effectiveness of therapy in women participating in mammography screening. Cancer. 2018 Nov 8. doi: 10.1002/cncr.31840. [Epubahead of print] PubMed PMID: 30411328.
[9]https://seer.cancer.gov/about/overview.htmllast accessed 7/16/2021
[10]Bleyer A,Welch HG. Effect of three decades of screening mammography on breast-cancer incidence. N Engl J Med. 2012 Nov 22;367(21):1998-2005
[11]Welch HG, Gorski DH, Albertsen PC.Trends in Metastatic Breast and Prostate Cancer. N Engl J Med. 2016 Feb 11;374(6):596
[12]Helvie MA, Chang JT,Hendrick RE, Banerjee M. Reduction in late-stage breast cancer incidence in the mammography era: Implications for overdiagnosis of invasive cancer. Cancer.2014 Sep 1;120(17):2649-56
[13]Anderson WF, Jatoi I, Devesa SS. Assessingthe impact of screening mammography: Breast cancer incidence and mortalityrates in Connecticut (1943-2002). Breast Cancer Res Treat. 2006Oct;99(3):333-40.
[14]Kopans DB.Arguments Against Mammography Screening Continue to be Based on Faulty Science.The Oncologist 2014;19:107–112
[15]https://seer.cancer.gov/statfacts/html/breast.html last accessed7/23/2021
[16]PulitiD, Duffy SW, Miccinesi G, de Koning H, Lynge E, Zappa M, Paci E;EUROSCREEN Working Group. Overdiagnosis in mammographic screening for breast cancer in Europe: a literature review. J Med Screen. 2012;19Suppl 1:42-56.
[17]DuffySW, Agbaje O, Tabar L, Vitak B, Bjurstam N, Björneld L, Myles JP, Warwick J.Overdiagnosis and overtreatment of breast cancer: estimates of overdiagnosis from two trials of mammographic screening for breast cancer. Breast Cancer Res.2005;7(6):258-65.


